Hoe één DNA-mutatie in borstkanker het immuunsysteem kaapt
31 jul. 2019 17:00
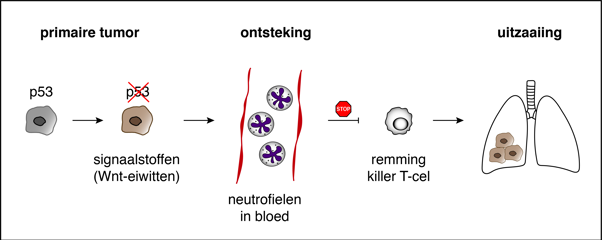
Eén defect gen in borsttumorcellen kan uitzaaiingen elders in het lichaam bevorderen door via een hele kettingreactie het immuunsysteem van de patiënt een ongewenste richting op te sturen. Een artikel over deze ontdekking van de onderzoekgroep van immunoloog en tumorbioloog Karin de Visser van het Nederlands Kanker Instituut, het LUMC en Oncode Institute verschijnt 31 juli in het wetenschappelijke tijdschrift Nature.
‘We waren behoorlijk verrast dat een enkel gen niet alleen processen binnen de kankercel reguleert, maar ook zo’n dominant effect heeft op het immuunsysteem in het hele lichaam’, zegt onderzoeker Max Wellenstein, eerste auteur van de publicatie.
Karin de Visser zegt: ‘Onze studie laat zien dat de genetische make-up van tumoren een grote impact heeft op het hele immuunsysteem én op het uitzaaigedrag van borstkanker. Deze inzichten leggen de basis voor de toekomstige ontwikkeling van nieuwe vormen van immuuntherapie die toegespitst zijn op de DNA-code van tumoren van individuele borstkankerpatiënten.’
Het gen in kwestie is P53, dat in tumorcellen van bijna 40% van de patiënten met borstkanker niet intact is. Het gen is een hoofdrolspeler bij kanker. Als het wél intact is, beschermt het namelijk tegen ongeremde celgroei. Het blijkt nu ook invloed te hebben op het immuunsysteem.
Max D. Wellenstein et al., Loss of p53 triggers Wnt-dependent systemic inflammationto drive metastasisof breast cancer’, Nature, 31 July 2019. DOI: 10.1038/s41586-019-1450-6.
 Nederlands (Nederland)
Nederlands (Nederland)